Wie Entzündungszellen Tumoren nützen
Magdeburger und Bonner Forscher gewinnen neue Einsichten in die Wirksamkeit von Krebs-Immuntherapien
Ein internationales Team unter der Leitung von Forschern der Universitätskliniken in Magdeburg und Bonn hat einen körpereigenen Bremsmechanismus aufgedeckt, der bislang die Wirksamkeit von Krebsimmuntherapien begrenzt. Die Wissenschaftler konnten ferner zeigen, dass durch eine Kombination mit zielgerichteten Hemmstoffen dieser Mechanismus ausgeschaltet und so eine Krebsimmuntherapie verbessert werden kann. Ihre Forschungsergebnisse veröffentlichten die Wissenschaftler in der aktuellen Ausgabe der renommierten Fachzeitschrift „Immunity“.
Einleitung in das Forschungsthema
Hauttumoren zählen in Deutschland zu den häufigsten Krebserkrankungen. Wiederholte schädliche Umwelteinflüsse, insbesondere häufige Sonnenbrände, führen dazu, dass sich gesunde Hautzellen in Krebszellen verwandeln. Die dabei ablaufenden Vorgänge in den Zellen konnten in den vergangenen Jahrzehnten mit Hilfe moderner molekular-genetischer Untersuchungsmethoden großteils aufgeklärt werden. Dieses Wissen ermöglichte die Entwicklung von zielgerichtet in die Tumorzellentwicklung und –ausbreitung eingreifende Therapien.
Als besonders hoffnungsvoll erwiesen sich sogenannte Immuntherapien bei Hauttumoren - insbesondere dem sich schnell ausbreitenden Schwarzen Hautkrebs (Melanom). Mit maßgeschneiderten Medikamenten – sogenannten „Immun-Checkpoint-Inhibitoren“ - greifen Mediziner in die Steuerungsvorgänge der zellulären Immunabwehr ein und reaktivieren die körpereigene Erkennung und Zerstörung der Krebszellen. Hoffnungsvoll stimmt, dass die modernen Immuntherapien bei Patienten in fortgeschrittenen, metastasierten Erkrankungs-stadien zur Tumorrückbildung führen können.
 Reaktivierung der körpereigenen Immunabwehr gegen Krebszellen
Reaktivierung der körpereigenen Immunabwehr gegen Krebszellen
Molekular maßgeschneiderte „Immun-Checkpoint-Inhibitoren“ aktivieren die T-Lymphozyten des körpereigenen Abwehrsystems. Diese erkennen nach dem Schlüssel-Schloss-Prinzip fremde oder fehlerhaft geformte Moleküle auf Zelloberflächen (sogenannte Antigene). Moderne Krebs-Immuntherapien reaktivieren T-Lymphozyten gegen Krebszellen. Dem bislang für das Immunsystem unsichtbaren körpereigenen Feind wird sozusagen der Tarnmantel entrissen.
Dieser Behandlungsansatz wurde ursprünglich für Patienten mit schwarzem Hautkrebs entwickelt und in der Folge auch bei anderen Krebsarten (z. B. Lungentumoren) mit beachtenswerten Erfolgen angewandt.
Ursachen von therapeutischen Rückschlägen untersucht
Trotz der beachtlichen Fortschritte in der Therapie enden viele Tumorerkrankungen tödlich. Auch die zielgerichteten Immuntherapien zeigen oft nur vorübergehende Wirkungen. Nicht selten schlagen die Immuntherapien bei Patienten in fortgeschrittenen Krankheitsstadien auch gar nicht an. Die Gründe dieses Therapieversagens werden weltweit von vielen Forschergruppen untersucht. Einen Beitrag dazu leistete ein internationales Forscherteam um Prof. Dr. Thomas Tüting, Direktor der Universitätshautklinik in Magdeburg.
Ein guter Botenstoff wechselt die Seiten
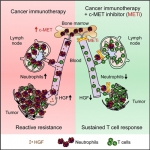
Um die Grenzen der Wirksamkeit moderner Krebs-Immuntherapien zu verstehen, haben die Forscher experimentelle Modelle in der Maus entwickelt. „Uns fiel auf, dass die Immuntherapie nicht nur T-Lymphozyten zur Krebsabwehr aktiviert, sondern auch Entzündungszellen aus dem Knochenmark, die sogenannten neutrophilen Granulozyten“ sagt Professor Tüting. Neutrophile Granulozyten schützen vor bakteriellen Infektionen und können prinzipiell auch Krebszellen angreifen. Letztere können sich diesen Angriffen jedoch mit verschiedenen molekularen Tarntechniken entziehen. „Dazu zählt, dass Krebsgewebe wie normales, verwundetes Gewebe reagieren kann und Entzündungsreaktion auslöst“, erklärt Privatdozentin Dr. Evelyn Gaffal, Oberärztin an der Universitätshautklinik in Magdeburg und Mitautorin der Studie. Möglich macht es ein Hepatozyten-Wachstumsfaktor, den auch die neutrophilen Granulozyten produzieren können. „Der körpereigene Signalstoff behindert die T-Lymphozyten im Kampf gegen Krebszellen, statt ihnen zu helfen“, beschreiben die Erstautoren der Studie, Nicole Glodde und Tobias Bald, die Untersuchungsergebnisse an genmodifizierten Mausstämmen. „Es ist, als ob dieser Botenstoff ein zweites böses Ich der Entzündungszellen zum Vorschein bringt, ähnlich wie bei der berühmten Romanfigur Dr. Jekyll, der sich durch einen geheimnisvollen Trank in den gewissenlosen Mörder Mr. Hyde verwandelt“ erläutert Prof. Dr. Michael Hölzel vom Institut für Klinische Chemie und Klinische Pharmakologie in Bonn.
Auf dem Weg zur Verbesserung von Krebsimmuntherapien
Durch eine gezielte Hemmung des freigesetzten Wachstumsfaktors konnte die Forschergruppe in den tierexperimentellen Modellen die Wirkung der Krebsimmuntherapie erheblich steigern. „Als nächstes müssen wir in klinischen Studien untersuchen, wie diese Erkenntnisse in der täglichen Praxis bei Krebspatienten angewendet werden können“ sagt Prof. Tüting. „Die an der Magdeburger Universität etablierten Forschungsverbünde wie der Sonderforschungsbereich 854 und der Gesundheitscampus Immunologie, Infektiologie und Inflammation (GC-I³) bieten exzellente Voraussetzungen für dieses ambitionierte Vorhaben.“
Text: Uwe Seidenfaden
Bild 1: Graphical Abstract (Quelle: Originalpublikation)
Bild 2: Die beiden Erstautoren Dr. Nicole Glodde und Dr. Tobias Bald vor einem Immunfluoreszenzbild; gezeigt wird, wie Neutrophile (rot) die T-Zellen (grün) hemmen. (Foto: Meri Rogava)
Bild 3: Prof. Dr. med. Thomas Tüting, Direktor der Universitätshautklinik Magdeburg. (Foto: Elke Lindner)






